注册及 CMC 团队核心成员均具备在国际生物医药领域超过 20 年的药物研发、生产和法规事务经验,熟知国内外相关政策及监管法规,可为客户制订合适的申报法规策略和实施方案, 以推动项目临床试验获批进度;对生物新药、生物类似药的国内外 IND 和 BLA 有着丰富的申报经验和深刻的法规认知,目前为客户提交或协助提交的所有申报均一次性获批。

迈百瑞控股子公司——烟台赛普生物技术有限公司,专业从事高品质哺乳动物细胞用无血清培养基开发、生产/代生产、销售等。
现有培养基品种已广泛应用于重组细胞株开发、细胞培养工艺开发以及商业化生产。凭借优异的产品性能,与市场同类产品相比具有极强的竞争力。
在CHO-K1、DG44、DXB11、CHO-S 等不同细胞系中表达各种类的治疗蛋白都有优异的表现。
在补料培养中,细胞密度峰值达 2×107/mL 以上,融合蛋白/单克隆抗体表达量可达 2~7g/L。
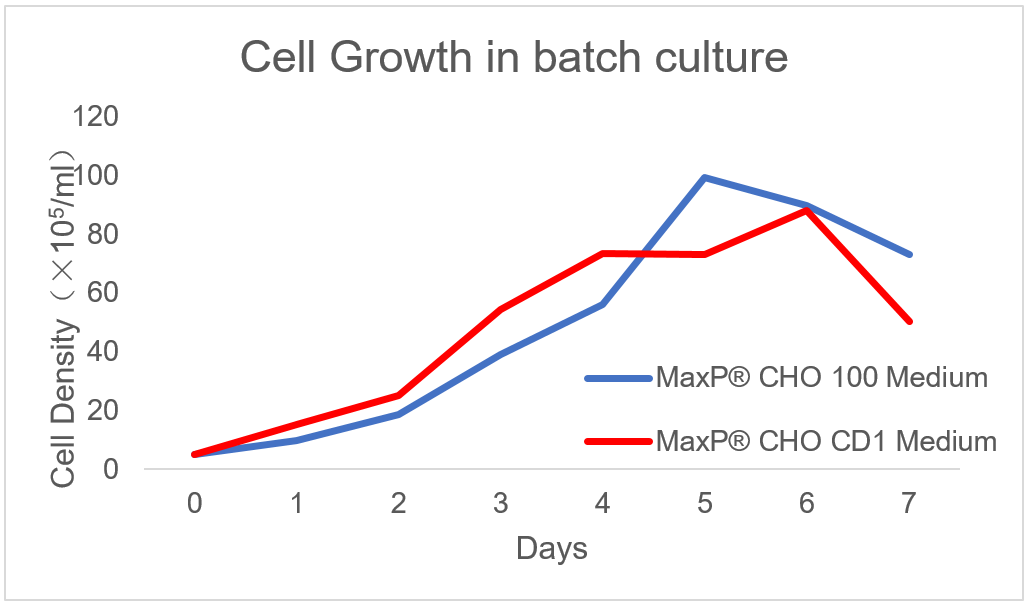
专为 CHO 细胞悬浮培养而设计的优异的化学成分限定培养基。
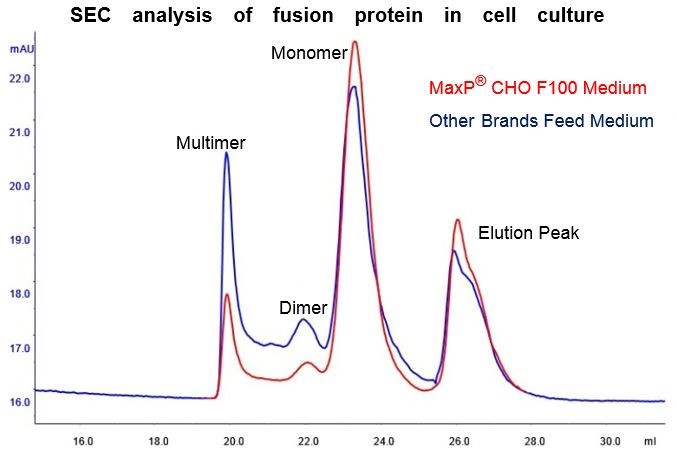
一种用于 CHO 细胞获得高细胞密度和表达量的补料培养基,用于抗体和融合蛋白的表达。在细胞培养过程中可显著降低融合蛋白聚集体比例。